2015年12月11日,口服新药Alecensa(Alectinib)获得美国食品药品监督管理局(FDA)加速批准,用于治疗经Xalkori(克唑替尼)治疗后病情恶化或不能耐受克唑替尼治疗的晚期(转移性)ALK阳性非小细胞肺癌(NSCLC)患者。
据美国国家癌症研究所报道,肺癌是美国癌症死亡的主要原因,2015年美国预计有221,200名新增肺癌病例和158,040名肺癌死亡病例。有几种不同的癌细胞包括肺癌细胞都会发生ALK(间变性淋巴瘤激酶)基因突变。大约5%的NSCLC患者具有ALK基因突变,而转移性ALK阳性NSCLC患者常出现肺癌脑转移。
“Alecensa的获批为不再对克唑替尼治疗敏感的ALK阳性NSCLC患者提供了一种新的治疗选择。”FDA药品评价与研究中心的血液与肿瘤药品办公室主任Richard Pazdur表示:“临床试验表明,Alecensa对这些患者的肺部原发肿瘤和脑内转移瘤均有抗肿瘤疗效。”
Alecensa是一种口服药,能够阻断ALK蛋白的活性,从而阻止NSCLC细胞的生长与扩散。
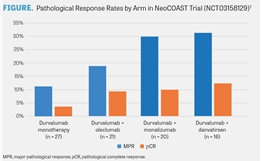
两项单臂临床试验证实了Alecensa的安全性与有效性。这两项临床试验的受试者都是不再对克唑替尼治疗敏感的转移性ALK阳性NSCLC患者,他们接受了一天两次的口服Alecensa治疗。第一项临床试验有38%的患者达到了NSCLC肿瘤部分缩小,且疗效平均持续了7.5个月。第二项临床试验有44%的患者达到了NSCLC肿瘤部分缩小,且疗效平均持续了11.2个月。这两项临床试验还评估了Alecensa对患者的脑内转移瘤的疗效。在具有可测量的脑内转移瘤的受试者中,有61%的受试者达到了脑内转移瘤完全消失或部分缩小,且疗效平均持续了9.1个月。
Alecensa最常见的副作用是疲劳、便秘、肿胀(水肿)和肌肉疼痛(肌痛)。此外,Alecensa还可能会导致严重的副作用,如肝脏疾病、严重或危及生命的肺部炎症、心跳过慢以及严重的肌肉疾病。Alecensa治疗可能会使患者在暴露于阳光下时被晒伤。
FDA经加速审批程序批准了Alecensa。加速审批程序用于批准重大或威胁生命疾病的治疗药物。如果新药物的临床数据显示,该药物能够影响替代终点指标(可合理预测患者获益的指标),那么这种药物就有资格获得加速审批。根据加速审批程序的要求,Alecensa的生产商需要开展一项证实性临床试验来证实Alecensa治疗带给患者的临床获益。
FDA授予了Alecensa突破性疗法认定和优先审批资格,这些独特程序旨在根据某些新药对重大或威胁生命的疾病的潜在疗效来促进和加速对它们的审批过程。Alecensa还获得了孤儿药认定,该程序为促进和鼓励药企开发罕见病的治疗药物提供了许多激励措施。
Alecensa由总部设在美国加州旧金山的基因泰克公司推广上市。Xalkori(克唑替尼)由总部设在美国纽约州纽约市的辉瑞制药公司推广上市。


曾任美国临床肿瘤学会(ASCO)临床实践指南委员会主席
约翰霍普金斯医学院,医学博士
Lifespan癌症研究所胸部肿瘤科主任
曾在纽约纪念斯隆凯特琳癌症中心任职10年
曾在波士顿的麻省总医院癌症中心任职6年

 400-107-6696
400-107-6696



 肺癌帮
肺癌帮
 11397
11397
 0
0

 15399
15399






 京公网安备 11010502037180号
京公网安备 11010502037180号
 400-107-6696
400-107-6696


