许多肿瘤免疫治疗方法从实验已经进入临床,而且,如今免疫治疗明星方案抗PD1/PDL1抗体、CART细胞疗法早已成为肿瘤治疗的药物。 然而,上述的免疫疗法也存在这样或者那样的不足,比如抗PD1/PDL1抗体只能针对部分患者有效,目前上市的CART疗法也只针对部分血液肿瘤并且价格极其昂贵。因此,开发新的肿瘤免疫治疗方法也相当迫切。 近日,一组来自斯坦福大学医学院的研究人员在《科学》杂志旗下著名学术期刊《科学-转化医学》发表一篇重磅研究文章,研究者们将微量两种免疫刺激剂直接注射到90只小鼠的实体瘤中,有效的消除了87只小鼠体内所有的癌症痕迹,为肿瘤免疫治疗带来了新的动力。 ?刹车和油门? 众所周知,T细胞的完全活化依靠“双信号”系统调控:第一信号来自其TCR(T细胞受体)与MHC(主要组织相容性复合体)的特异性结合,即T细胞对抗原识别;第二信号来自协同刺激分子,即抗原递呈细胞(APC)表达的协同刺激分子与T细胞表面的相应受体或配体相互作用介导的信号。 ▲T细胞共刺激及共抑制通路 而这第二信号来自协同刺激分子就包括两种: 第一种就是抑制性的(所谓的负性共刺激分子),比如此外为保证T细胞不被过度刺激,还有调节T细胞的负性共刺激分子,比如有CTLA4-B7通路和PD-1/PD-L1通路,主要是为了防止T细胞过度激活进而伤及其他正常组织;这就好比是汽车的“刹车”系统,免得汽车开太快;当然,糟糕的是,肿瘤细胞也学会了这一招,也变出一个这种抑制性信号通路来,从而抑制了T细胞的追杀;因此,科学家针对这一点,采用单抗来阻断PD-1/PD-L1,这样一来就相当于给T细胞松了刹车,能够让T细胞继续杀伤肿瘤细胞。 第二种就是激活性的(所谓的正性共刺激分子),即能够刺激T细胞激活的分子,比如有OX40、4-1BB等;这就好比是汽车的“油门”系统,可以使汽车加快行驶。 ?这篇研究? 明白了上面的“刹车”和“油门”之后,来看看由斯坦福大学的Ronald Levy教授领导的研究团队在《Science Translational Medicine》上面发表的论文,应该就非常容易理解了。 ▲领导这项研究的斯坦福大学的Ronald Levy教授,他也是癌症免疫疗法领域的先驱,他实验室中的研究导致了第一个被批准用于人类抗癌治疗的单克隆抗体—利妥昔单抗的诞生 研究者们采用一种叫做“CpG寡核苷酸”(CpG oligonucleotide)的DNA短链(TLR9的配体),注射到小鼠的肿瘤部位,然后来观察各种免疫细胞的反应。 结果竟然发现,CpG寡核苷酸能够增加CD4阳性T细胞表面的OX40的表达,前面也讲了,OX40是一个正性共刺激分子,能够激活T细胞,相当于“油门”。 ▲体内实验也表明CpG寡核苷酸诱导CD4 T细胞中OX40的表达,左边为对照组,右边的小鼠注射CpG之后,在肿瘤部位OX40明显增多 研究者们相当高兴,这个CpG寡核苷酸是个好东西,为何?因为它能够诱导CD4阳性T细胞表面的OX40的表达,而OX40信号通路则相当于T细胞的“油门”,能够有效地刺激T细胞的活性。 因此,研究者们接下来就想看看这两个东西联合在一起,能不能消灭肿瘤呢? ?免疫疗法也流行联合? 众人拾材火焰高,十双筷子折不断,这说明了联合的力量! 把CpG和OX40联合起来,看看对肿瘤细胞的清除能力,这正是斯坦福大学的研究者接下来要做的。 ▲CpG寡核和anti-OX40抗体联合治疗让荷瘤小鼠的生存率几乎是100% 研究者们把CpG寡核苷酸(每只小鼠每天注射50ug)和anti-OX40抗体(每只小鼠每天注射4ug)联合治疗荷瘤小鼠,结果生存率几乎100%。而其他各组,包括单独使用CpG,或者单独使用anti-OX40抗体,均不能有效治疗小鼠的肿瘤。 当然,研究者们还更进一步,在自发(自然发生)肿瘤小鼠模型(与人类肿瘤更为接近)中来实验,结果也显示出显著的治疗效果。


曾任美国临床肿瘤学会(ASCO)临床实践指南委员会主席
约翰霍普金斯医学院,医学博士
Lifespan癌症研究所胸部肿瘤科主任
曾在纽约纪念斯隆凯特琳癌症中心任职10年
曾在波士顿的麻省总医院癌症中心任职6年

 400-107-6696
400-107-6696



 海堰
海堰
 11033
11033
 1
1


 5004
5004

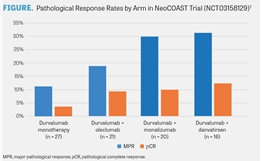
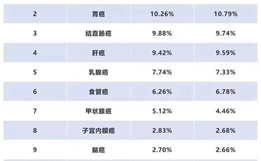
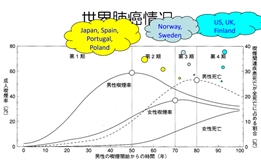





 京公网安备 11010502037180号
京公网安备 11010502037180号
 400-107-6696
400-107-6696


